Douleur et pratiques artistiques
Qu’elle est la régulation de la douleur ?

La perception de la douleur n’est pas le simple aboutissement de la transmission d’un signal nociceptif vers un centre d’analyse mais celui d’interactions complexes entre les voies afférentes de la douleur et les dispositifs qui modulent le message nociceptif. L’information douloureuse ne circule pas de façon linéaire, mais elle est modulée dès son arrivée dans la moelle, puis à différents niveaux du SNC. Cette modulation peut être excitatrice ou inhibitrice, augmentant la douleur ou produisant l’analgésie. Les mécanismes endogènes de modulation de la douleur sont très nombreux et font appel à une grande quantité de neurotransmetteurs dont certains qui sont normalement inhibiteurs de la douleur comme la sérotonine ou la noradrénaline peuvent devenir excitateurs. Les différentes voies nociceptives sont en permanence modulées au niveau des différents relais, soit par d’autres informations sensorielles, soit par des structures supraspinales.
Ces mécanismes endogènes sont retrouvés aux niveaux
- 1) des mécanismes spinaux aux effets localisés,
- 2) des contrôles inhibiteurs descendants aux effets diffus,
- 3) des mécanismes intervenant au niveau des centres supérieurs aux effets diffus ou localisés selon les cas.
Pour les mécanismes de contrôle, il faut noter que l’activité des neurones à convergence est sous la dépendance d’influences excitatrices et inhibitrices ; les premières sont essentiellement d’origine périphérique, mais les secondes peuvent être d’origine périphérique (segmentaire) ou centrale. Selon la théorie du portillon, la « Gate control theory », la transmission des messages nociceptifs est réglée par un effet de balance entre ces diverses influences, et la douleur ne survient que lorsqu’il y a rupture d’équilibre en faveur des messages excitateurs (soit par excès de nociception, soit par déficit des contrôles inhibiteurs). Ces phénomènes de modulation sont classés selon l’origine des mécanismes d’inhibition qui leur ont donné naissance en contrôles segmentaires et contrôles d’origine supraspinale.
Les mécanismes spinaux
Les contrôles segmentaires
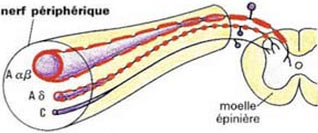 Le premier lieu d’intégration de la douleur se situe dans la corne postérieure de la moelle. Les inter-neurones de la substance gélatineuse de Rolando pouvant inhiber la transmission des influx nociceptifs vers les neurones convergents et donc vers le SNC. Dans leur célèbre théorie du portillon, Melzack et Wall avancent que la stimulation sélective des fibres afférentes myélinisées de gros calibre Aβ, non nociceptives, bloquent les petites fibres nociceptives Aδ et C de la substance gélatineuse (lames I et II) des cornes postérieures de moelle.
Le premier lieu d’intégration de la douleur se situe dans la corne postérieure de la moelle. Les inter-neurones de la substance gélatineuse de Rolando pouvant inhiber la transmission des influx nociceptifs vers les neurones convergents et donc vers le SNC. Dans leur célèbre théorie du portillon, Melzack et Wall avancent que la stimulation sélective des fibres afférentes myélinisées de gros calibre Aβ, non nociceptives, bloquent les petites fibres nociceptives Aδ et C de la substance gélatineuse (lames I et II) des cornes postérieures de moelle.
Un interneurone inhibiteur, recruté par les grosses fibres responsables des afférences non nociceptives (Aβ) et inhibé par les petites fibres nociceptives (Aδ, et C) module la douleur au niveau de la moelle. Selon la théorie du portillon, la stimulation sélective des fibres afférentes non nociceptives soulage la douleur en réduisant la transmission de l’information nociceptive directement à son entrée dans la moelle. Ce type d’inhibition est segmentaire, n’opérant que sur le territoire du dermatome stimulé. Un exemple banal de la modulation des stimuli douloureux est la possibilité de réduire une sensation de douleur aiguë en activant des mécanorécepteurs de bas seuil : si l’on se heurte le tibia ou que l’on se cogne un orteil, la réaction naturelle et efficace est de se frotter vigoureusement, pendant une minute ou deux l’endroit où l’on s’est fait mal. Le flux des messages nociceptifs transitant par la moelle est modulé par l’activation concomitante des grosses fibres myélinisées innervées par les mécanorécepteurs de bas seuil.
Les grosses fibres entretiendraient un tonus inhibiteur, lequel serait levé par l’arrivée « suffisante » d’une volée nociceptive, entraînant l’ouverture du portillon. Ainsi, la douleur peut naître, soit d’un excès d’influx nociceptifs, soit d’un défaut du contrôle inhibiteur, soit encore des deux mécanismes imbriqués. Plus tard Wall a proposé de remplacer le neurone inhibiteur par un couple d’interneurones, l’un excitateur, activé par les fibres nociceptives, l’autre inhibiteur et activé par les collatérales des fibres tactiles. Plus tard, Jessel et Iversen ont montré que l’inhibition des fibres nociceptives par l’interneurone dépendait de la libération d’un neuromédiateur : enképhaline ou/et GABA, qui se comporte comme une clé qui va se fixer sur un récepteur, la serrure, située à l’extrémité de la fibre nociceptive en position pré-synaptique, inhibant ainsi la libération par cette fibre, de ses propres neurotransmetteurs (A.A.E.), neurokinines… Ainsi, la théorie de la porte se complète naturellement par celle de la clé et de la serrure !!
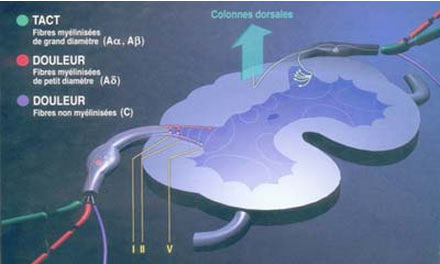
Il existe dans la moelle des régions sensibles aux opiacés : Au niveau de moelle on retrouve des récepteurs aux endorphines, localisés dans les lames superficielles de la corne dorsale, qui provoquent une forte inhibition des fibres afférentes primaires ainsi que de l’activité des neurones de deuxième ordre.
Les mécanismes descendants
Ces contrôles sont dits supra spinaux en référence à leur origine, mais comme les précédents ils s’exercent sur la corne dorsale de la moelle qui se révèle ainsi un haut lieu de convergence des mécanismes de modulation. Quelques années après la publication de la théorie du portillon, Reynolds montre que la stimulation de la Substance Grise Péri Aqueducale (SGPA) chez un rat provoque une analgésie suffisante pour réaliser une intervention chirurgicale. La stimulation de régions spécifiques, dont la SGPA et le noyau du raphé (NRM), est capable d’induire une analgésie profonde résultant de l’activation de voies inhibitrices descendantes qui bloquent la transmission spinale des messages nociceptifs, en libérant la sérotonine et des opioïdes endogènes dans les couches superficielles de la corne postérieure. Les voies descendantes sérotoninergiques et noradrénergiques, ayant pour fonction de recruter les interneurones enképhalinergiques dans la moelle pour donner une analgésie par réduction de l’activité des afférences nociceptives.
Le Contrôle Inhibiteur Diffus Nociceptif (CIDN) : ce modèle expose comment une stimulation nociceptive localisée peut produire une hypoalgésie généralisée des afférences nociceptives. La stimulation douloureuse, en plus de conduire l’information nociceptive vers les centres supérieurs par la voies spinothalamique, envoie des afférences vers différents centres du tronc cérébral dont la SGPA et les NRM qui vont envoyer des efférences inhibitrices vers les divers segments spinaux et produire une inhibition diffuse. La stimulation nociceptive active le pool de neurones nociceptifs correspondant au segment spinal qu’ils innervent, tout en inhibant les autres neurones nociceptifs du reste du corps. En réduisant l’activité des neurones nociceptifs non spécifiques , le CIDN atténuerait le bruit de fond et ferait ressortir l’activité des neurones spécifiques sollicités par la stimulation nociceptive. Ainsi la douleur ne serait pas uniquement le résultat des processus excitateurs, mais proviendrait de la perception d’un contraste entre les activités des neurones excitateurs et les activités des neurones inhibiteurs.
Les neurotransmetteurs du système inhibiteur descendant : comprennent les transmetteurs biogéniques aminés et les opiacés (endorphines).
- Les régions SGPA et NRM , activées par les stimuli nociceptifs médullaires, ont des neurones riches en récepteurs aux endorphines. L’information va descendre par les faisceaux postéro-latéraux et libérer les transmetteurs biogéniques aminés que sont la sérotonine et la noradrénaline, au niveau de l’apex de la corne dorsale de la moelle. Leurs actions médullaires sont rendues possibles grâce à des récepteurs noradrénergiques concentrés dans les lames supérieures de la moelle. Ces monoamines provoquent la libération de substances opioïdes endogènes par les interneurones inhibiteurs localisées dans les lames I, II et V de la moelle. L’action de ces interneurones est à la fois pré et post-synaptique sur les afférences nociceptives primaires. La sérotonine issue des neurones sérotoninergiques agit directement sur les neurones de la corne dorsale pour les inhiber.
- L’efficacité des opiacés s’explique par l’existence de récepteurs opiacés spécifiques contenus dans certaines synapses des lames supérieures de la corne dorsale, ainsi que dans la SGPA et le NRM. Mais certains neurones renferment des dérivés d’opiacés qui peuvent se libérer quand la situation le nécessite. Parmi ces dérivés, les enképhalines se trouvent surtout dans le système parasympathique, il y a aussi des dynorphines et des β-endorphines.
Modulation des centres nerveux supérieurs
Bien que tout ne soit pas encore compris du traitement cortical des informations nociceptives, il apparaît que l’intégrité du cortex est indispensable à toute sensation douloureuse. Les centres supérieurs jouent un rôle prédominant dans la modulation de la douleur. Nous savons depuis longtemps que la douleur est une expérience sensorielle et émotionnelle complexe exigeant la participation des centres supérieurs du SNC. Ce n’est qu’une fois l’information nociceptive rendue au cortex qu’il est vraiment possible de parler de douleur, puisque la douleur est une perception.
Comme pour le thalamus la représentation cérébrale est partagée entre les afférences de la voie sensori-discriminative et celle de la voie motivo-affective. L’imagerie médicale, au moyen de la tomographie par émission de positons (TEP), a confirmé la participation de quatre pricipaux centres cérébraux : le cortex somatosensoriel primaire (S1) et le cortex somatosensoriel secondaire (S2) au niveau temporal, le cortex cingulé antérieur (CCA) au niveau du corps calleux, et l’insula au niveau du cortex cingulaire (CI). Les structures S1 et S2 sont principalement liées à la composante sensoridiscriminative de la douleur, alors que CCA et CI le sont dans la composante motivo-affevtive.
La composante sensoridiscriminative dans le cortex somatosensoriel primaire (S1)
La voie spinothalamique arrivant au complexe ventrobasal du thalamus se projette sur S1 et S2. La lésion de ces régions produit une perte dans les capacités de préciser la localisation ou l’intensité de la douleur. Mais des lésions du cortex pariétal peuvent parfois produire de l’hyperalgésie.
La composante sensoridiscriminative dans le cortex somatosensoriel secondaire (S2)
Chez les patients ayant subi une hémisphèrectomie, la stimulation de la jambe controlatérale produit une activation de S1 du même coté que la jambe stimulée. Cette réorganisation corticale met en évidence les réseaux existant entre S1 et S2.
La composante motivo-affective de la douleur du cortex cingulé antérieur (CCA)
Les douleurs viscérales à forte composante affective, comme celles rencontrées dans le colon irritable, activent préférentiellement cette structure.
La composante motivo-affective de la douleur du cortex insulaire (CI)
L’insula a des contacts avec les structures limbiques comme l’amygdale suggérant un rôle dans la composante affective de la douleur. La stimulation de CI produit une sensation émotive de peur, alors que sa lésion détermine une absence de réponses émotives aux stimulations nociceptives.
Nous comprenons la complexité de l’équilibre entre les composantes sensorielles et affectives. Si certains centres se spécialisent dans la composante sensoridiscriminative de la douleur (S1, S2) pour donner des informations précises sur la localisation et l’intensité, d’autres s’intéressent à l’appréciation émotive de la douleur (CCA, CI). L’empathie face à la douleur d’autrui active les mêmes centres cérébraux de la composante émotivo-affective de la douleur. Ainsi, notre perception de la douleur d’autrui est cérébralement bien réelle.
A coté de la perception, ces régions cérébrales interviennent aussi dans la modulation de la douleur. La lobotomie dissociant le lobe frontal (de la pensée rationnelle), du système limbique (lié à l’émotion), provoque une dissociation entre l’intensité et l’aspect désagréable de la douleur.
L’hypnose permet d’augmenter ou de diminuer l’aspect désagréable d’une douleur, mais parallèlement l’activité cérébrale était aussi modifiée.
L’odeur est appréciée par le système olfactif lié au système limbique responsable des émotions. Les tests pratiqués ont permis de montrer qu’il y avait une réduction de la douleur avec l’inspiration d’odeurs agréables mais seulement chez les femmes. Les hormones sexuelles sont déterminantes dans la perception de la douleur et dans les mécanismes endogènes de modulation de la douleur. Ainsi une stimulation externe du système limbique (comme une odeur) peut influencer notre perception de la douleur.
Les réactions à la douleur peuvent être volontaires ou involontaires. Le réflexe nociceptif survient avant même que l’information douloureuse n’arrive à la conscience. De même, divers comportements comme ceux liés au système sympathique (sudation, tachycardie, mydriase), ou aux expressions faciales, sont involontaires. Les comportements conscients de la douleur viennent ensuite et ont pour rôle de communiquer la perception de la douleur.
De la périphérie aux centres nerveux supérieurs, l’information nociceptive chemine, passant de la transduction sensorielle à la transmission, à la modulation et enfin à la perception. Elle est ensuite traduite en comportement douloureux exprimant la souffrance et réclamant le traitement. Les systèmes de modulation qui se retrouvent à tous les niveaux représentent bien la difficulté qu’il y a à établir un lien direct entre l’activation d’un nocicepteur et le ressenti douloureux.
- Quelles sont les différentes approches de la douleur ?
- Qu’elle est l’anatomie de la douleur ?
- Quels sont les récepteurs de la Douleur
- Quels sont les mécanismes périphériques de la nociception ?
- Quelle est l’organisation dans la corne postérieure ?
- Transfert des messages nociceptifs à partir de la moelle
- Qu’elle est la régulation de la douleur ?
- Les différences de genre (Hommes/Femmes) dans la douleur, exemple de régulation hormonale de la douleur
- Endormophines et pratiques artistiques



